2021年12月2日,上海师范大学命科学学院邢维满及中国科学学院分子植物科学卓越创新中心/中国科学学院上海植物逆境生物研究中心雷明光共同通讯在 Nature Communications 在线发表题为”Mechanism of phosphate sensing and signaling revealed by rice SPX1-PHR2 complex structure”的研究论文,解析了SPX-PHR复合物的晶体结构,结合生化分析揭示了磷感知并传递到下游的新机制。

磷元素是生命必须的大量营养元素,是许多细胞分子的关键组分,如遗传物质DNA和能量载体ATP。磷主要以磷酸盐(Pi)的形式被真核生物吸收利用。生物细胞都需要在其细胞质中保持足够浓度的磷酸盐 (Pi)。对于植物而言,土壤中无机磷的流动性低,导致可用性较差 。为了响应土壤 Pi 含量的变化,植物进化出复杂的分子机制来调节 Pi 吸收和转化。
PHR 转录因子是 Pi 信号传导的中心调节因子,它与磷酸盐饥饿诱导 (PSI) 基因的启动子区域中的 PHR1 结合序列 (P1BS) 结合。通过激活 PSI 基因的表达,PHR 在 Pi 缺乏的条件下增强了 Pi 吸收。另一方面,为了避免由植物中过量的 Pi 积累引起的 Pi 毒性,SPX 蛋白与 PHR 蛋白结合并在 Pi 充足的条件下使 PHR 诱导的转录失活。
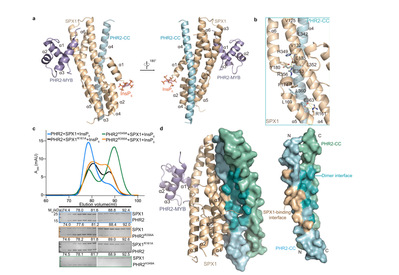
Fig.1 SPX1-PHR2 CC interface is compatible with PHR2 dimer interface
植物如何感知细胞 Pi 水平以操纵 PHR2 诱导的 PSI 基因表达是 Pi 稳态中一个关键问题。PHR 蛋白属于 MYB 卷曲螺旋 (MYB-CC) 家族,其特征是保守的 MYB DNA 结合域和潜在的 CC 二聚化域。拟南芥 PHR1 的二聚化已被证明对其高亲和力 DNA 结合功能很重要。先前的研究表明,水稻 SPX1 以 Pi 依赖性方式与 PHR2 相互作用,并作为抑制剂在 Pi 充足的条件下抑制 PHR2 转录激活。这些发现暗示了含有 SPX 结构域的蛋白质在感知 Pi 中的重要作用。
最近对 SPX 域的结构分析,结合体内研究,支持 SPX 域作为 Pi 传感器的功能。有趣的是,SPX 域似乎并不直接感知无机 Pi,而是识别可溶性肌醇多磷酸盐 (InsPs),例如 InsP7 或 InsP8,它们充当细胞 Pi 状态的代理。最近通过与 InsP6 复合的 SPX 域的晶体结构揭示了这种机制。
尽管最近取得了这些进展,但 SPX 域蛋白如何识别 InsP 分子并调节 Pi 稳态中的下游参与者仍不清楚。
本研究分析了 InsP6 与水稻 SPX1-PHR2 复合物结合的影响,并确定了 InsP6 结合的 SPX1-PHR2 复合物结构。结合生化研究,该研究结构揭示了 SPX1 介导 Pi 传感和信号传导的独特双重机制。该研究表明在结合 InsP6 后,SPX1 可以破坏 PHR2 二聚体并形成 1:1 SPX1-PHR2 复合物。复杂的结构表SPX1 螺旋 α1 在与 PHR2 二聚体相互作用时可以施加空间位阻。通过稳定螺旋 α1,InsP6 变构解耦 PHR2 二聚体并稳定 SPX1-PHR2 相互作用。InsP6 进一步允许 SPX1 与PHR2 MYB 结构域结合并在空间上阻断其与 DNA 的相互作用。
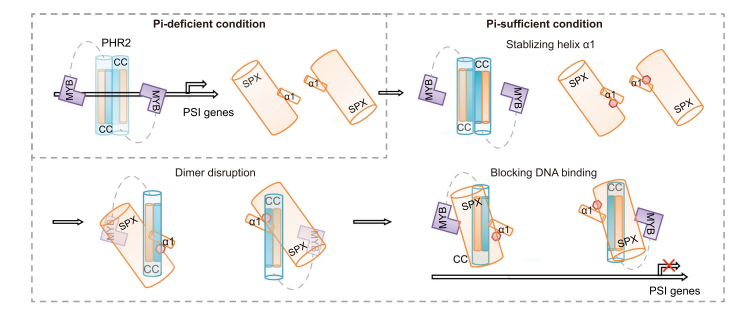
Fig.2 InsP6-induced and SPX1-mediated PHR2 dimer dissociation and DNA binding inhibition.
总之,该结果表明在感知磷酸盐的替代信号后,SPX1 通过双重机制抑制 PHR2,减弱 PHR2 的二聚化和 DNA 结合活性。
文章链接:https://www.nature.com/articles/s41467-021-27391-5
